Turinys
- etapai
- 1 dalis Skirtingų joninės lygties elementų supratimas
- 2 dalis. Nustatykite grynųjų jonų lygtį
Chemijoje grynosios joninės lygtys yra labai naudingos tuo, kad apibūdina pagrindinius reakcijų faktus. Jie dažnai naudojami skaičiuojant oksidacijos-redukcijos reakcijas, dvigubo pakeitimo reakcijas (arba susietus pakaitalus) ir rūgščių-šarmų neutralizaciją. Norint nustatyti grynąją joninę lygtį, dažnai reikia pereiti tris veiksmus: subalansuoti molekulinę lygtį, paversti ją jonų lygtimi (tai yra nustatyti rūšis, kurios baigiasi tirpale) ir galiausiai sudaryti grynąją jonų lygtį.
etapai
1 dalis Skirtingų joninės lygties elementų supratimas
-

Skirkite skirtumus tarp molekulinių junginių ir joninis. Su jonine lygtimi pirmiausia reikia nustatyti joninius junginius. Tai yra tie, kurie sudarys cinko kiekį vandeniniame tirpale (joniniame tirpale), todėl jie įkraus. Molekuliniai junginiai yra elektriškai neutralūs. Paprastai jie susideda iš mažiausiai dviejų nemetalų ir kartais yra vadinami „kovalentiniais junginiais“.- Joniniai junginiai atsiranda dėl reakcijos tarp metalo ir nemetalo, tarp metalo ir poliaatominių jonų arba tarp poliaatominių jonų.
- Jei nesate tikri dėl junginio pobūdžio, žiūrėkite periodinių elementų lentelę iš elementų, kurie jį sudaro.
-

Nustatykite junginio tirpumą. Ne visi joniniai junginiai tirpsta vandeniniame tirpale, jie liks tokie, kokie yra, ir neišskiria jokių jonų. Prieš atlikdami ką nors cheminės lygties lygyje, turite nustatyti kiekvieno junginio tirpumą. Žemiau rasite keletą tirpumo taisyklių. Norėdami gauti daugiau informacijos apie tirpumą, žiūrėkite kokybinę tirpumo lentelę.- Prisiminkite kai kurias taisykles, reglamentuojančias šias druskas:
- visos Na, K ir NH druskos4 tirpsta,
- visos NE druskos3, C2O3O2, ClO3 ir ClO4 yra tirpūs.
- visos druskos Ag, Pb ir Hg2 yra netirpūs,
- visos druskos Cl, Br ir I yra tirpios,
- visos CO druskos3, O, S, OH, PO4, CrO4, Kr2O7 ir SO3 yra netirpūs (išskyrus
- visos SO druskos4 yra tirpūs (išskyrus išimtis).
-

Nustatykite junginio katijoną ir lanioną. Katijonai yra teigiami junginio jonai ir paprastai priklauso metalų šeimai. Anijonai yra neigiami nemetalų jonai. Kai kurie nemetalai kartais gali duoti katijonus, tik metalai sistemingai juos duos.- Taigi, naudojant NaCl, Na yra teigiamai įkrautas, jis yra katijonas, nes tai yra metalinis elementas. Kita vertus, Cl turi neigiamą krūvį, jis yra lanionas, nes tai yra nemetalinis molekulės elementas.
-

Žinoti, kaip atpažinti poliaatominius jonus reakcijoje. Tai yra elektra įkrautos molekulės, kurių ryšius ypač sunku sulaužyti vykstant cheminei reakcijai. Svarbu žinoti, kaip juos atpažinti, kiekvienas su konkrečiu įkrovimu. Jie nebus suskirstyti į juos sudarančius elementus. Poliaatominiai jonai gali būti teigiamai įkrauti (poliaatominiai katijonai) arba neigiamai (poliaatominiai anijonai).- Vidurinėje mokykloje, atsižvelgiant į lygį, jūsų bus paprašyta atsiminti kelis dažniausiai pasitaikančius poliaatominius jonus.
- Chemijoje dažniausiai sutinkami poliaatominiai jonai: CO3, NE3, NE2Taigi4Taigi3, ClO4 ir ClO3 .
- Jų yra daug daugiau, juos rasite sugrupuotus pagal mokesčių kategorijas chemijos knygoje arba internete.
2 dalis. Nustatykite grynųjų jonų lygtį
-
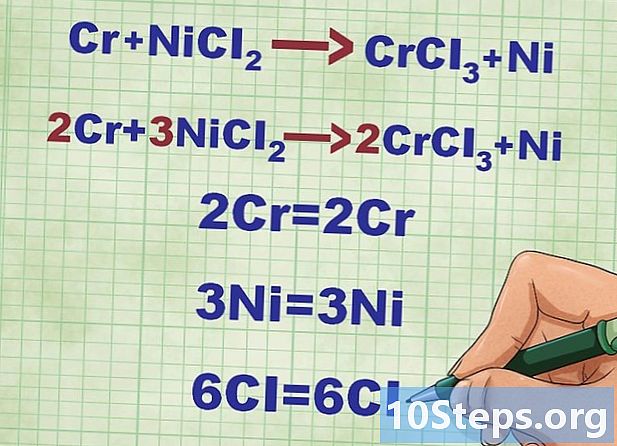
Subalansuokite molekulinę lygtį. Prieš rašydami grynąją joninę lygtį, turite įsitikinti, kad pradinės cheminės reakcijos lygtis yra subalansuota.Tam jūs turite turėti tiek daug kiekvienos rūšies duomenų schemų vienoje ir kitoje lygties pusėje. Štai kodėl dažnai reikia dėti koeficientus (į dešinę arba į kairę) į tą ar tą elementą, kad reakcija būtų subalansuota.- Reaguokite: Cr + NiCl2 -> CrCl3 + Ni, Suskaičiuokite visų elementų duomenų skaičių kiekvienoje lygties pusėje. Cr ir Ni atomai yra subalansuoti.
- Balansuokite chloro atomus (Cl). Kairėje yra dvi, dešinėje - trys. Norėdami subalansuoti, turime pridėti 3 kairėje ir 2 dešinėje, tada Cr ir Ni yra nesubalansuoti.
- Subalansuokite tinkamuosius nikelio atomus (3Ni).
- Balansuokite chromo atomus kairėje (2Cr).
- Patikrinkite, ar duomenų, nurodytų kiekvienoje lygties pusėje, skaičius yra vienodas.
- Taigi, „Cr + NiCl“2 -> CrCl3 + Ni tampa 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
-

Nurodykite kiekvieno junginio fizines būsenas. Jie turės atsirasti lygtyje. Gana dažnai pratimo formuluotė šiek tiek nurodo tam tikro junginio, bent jau pradinio, būklę. Jei fizinės būsenos jums nesuteiktos, yra ir kitų būdų joms surasti.- Jei elemento materialinė būsena jums nėra pateikta, nuskaitykite jį iš periodinės elementų lentelės.
- Jei junginys yra laikomas „tirpalu“, tikrai galite pasakyti „aq“ („vandeniniam“).
- Jei reakcija vyksta esant vandeniui, patikrinkite tirpumo lentelę, kad joninis junginys ištirps. Jei jis labai gerai tirpsta, junginys bus vandeninis (AQ), priešingu atveju jums reikės pažymėti „s“, jei norite tvirtai.
- Jei lygtyje nėra vandens, joninis junginys yra kieto būvio (ai).
- Jei pratime minima rūgštis arba bazė, junginys bus vandeninis (AQ).
- Paimkime pavyzdį: 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Savo pradinėse formose Cr ir Ni yra kieti. Nicl2 ir CrCl3 yra tirpūs joniniai junginiai, todėl vandeniniai. Lygtį galime perrašyti taip: 2Cr(ai) + 3NiCl2(AQ) -> 2CrCl3(AQ) + 3Ni(ai)
-

Nustatykite chemines rūšis, kurios atsiskiria. Tirpale visada yra junginių, kurie disocijuojasi (katijonuose ir anijonuose). Kai rūšis ar junginys išsiskiria, jis išsiskiria į teigiamus jonus (katijonus) ir neigiamus jonus (anijonus). Tuomet turės būti atkurta elektrinė pusiausvyra, o tai daroma grynosios joninės lygties metu.- Kietos medžiagos, skysčiai, dujos, molekuliniai junginiai, mažai tirpūs joniniai junginiai, poliaatominiai jonai ir silpnos rūgštys neišsiskiria.
- Joniniai junginiai, pasižymintys dideliu tirpumu (norint patikrinti tirpumo lentelę), ir stipriosios rūgštys iš viso sudaro: HCl(AQ), HBr(AQ), HI(AQ), H2SO4(AQ), HClO4(AQ) ir HNO3(AQ) .
- Tačiau atminkite, kad jei poliaatominiai jonai neišsiskirtų, jie be druskos atskirtų junginį, kuriame jie yra.
-

Apskaičiuokite kiekvieno atsiribojusio jonų krūvį. Atminkite, kad metalai visada suteikia katijonus, o dauguma nemetalų - anijonus. Norėdami sužinoti kiekvieno elemento apkrovą, naudokite periodinių elementų lentelę. Tada turėsite subalansuoti kiekvieno junginio jonų krūvius.- Paimkime savo pavyzdį. Nicl2 duos iš vienos pusės Ni ir Cl, o CrCl3 išsiskirs į Cr ir Cl.
- Jei nikelio (Ni) įkrova yra 2+, šis krūvis yra kompensuojamas dviem chloro jonais, kurių kiekvienas turi vieną neigiamą krūvį (1-). Panašiai liūto chromo (Cr) krūvis yra 3+, todėl yra trys neigiami chloro jonai.
- Atminkite, kad poliaatominiai jonai turi specifinį krūvį.
-

Parašykite lygtį. Užrašykite jį nurodydami visus gauto tirpalo joninius junginius, kurie dabar suskaidomi į jonus. Viskas, kas turi išsiskirti ar sionizuotis (stiprios rūgštys), atsiskirs į du skirtingus jonus. Medžiagos būklė išliks tokia pati (AQ), belieka patikrinti, ar lygtis išlieka subalansuota.- Kietos medžiagos, skysčiai, dujos, silpnos rūgštys ir mažo tirpumo jonų junginiai nepakeis būsenos ar neišsiskirs į jonus, todėl turite palikti juos nepakeistus.
- Molekulinės medžiagos ištirps tirpale, todėl būsena taps vandeninga (AQ). Yra trys šios taisyklės išimtys: CH4(g), C3O8(g) ir C8O18(L) nesibaigs vandenine forma.
- Paimkime savo pavyzdį. Joninė lygtis dabar yra: 2Cr(ai) + 3Ni(AQ) + 6Cl(AQ) -> 2Cr(AQ) + 6Cl(AQ) + 3Ni(ai), Chloras, kuris nėra junginio sudedamoji dalis, nėra diatominis. Štai kodėl mes padauginome jo koeficientą iš junginyje esančių duomenų, kurie suteikia 6 Cl jonus kiekvienoje lygties pusėje, skaičiumi.
-

Pašalinkite žiūrovų jonus. Tai jonai, kurie reakcijos metu nereaguoja. Mes galime juos pašalinti iš kiekvienos lygties pusės. Vienintelė riba yra tai, kad galima pašalinti tik tapačius jonus (krūvį ir indeksą). Užrašykite lygtį be šių žiūrovų jonų.- Mūsų pateiktame pavyzdyje kiekvienoje pusėje yra 6 Cl žiūrovų jonai. Jie nereagavo, galime priversti juos dingti iš lygties. Jūsų grynoji joninė lygtis yra: 2Cr(ai) + 3Ni(AQ) -> 2Cr(AQ) + 3Ni(ai)
- Norint patikrinti, ar gerai dirbote, bendra reagento apkrova (kairėje nuo grynosios jonų lygties) turi būti lygi gaminių apkrovai (dešinėje).