
Turinys
Šiame straipsnyje: Greitų taisyklių naudojimasSkaičiuokite „Ksp9“ nuorodų tirpumą
Tirpumas yra terminas, naudojamas chemijoje apibūdinti kietų junginių, kurie visiškai ištirpsta skysčiuose, savybes, nepalikdami neištirpusių dalelių. Tirpsta tik joniniai junginiai (elektra įkrauti). Norėdami išspręsti praktines problemas, turite įsiminti kai kuriuos principus arba naudoti tirpumo taisyklių lentelę. Tai padės jums sužinoti, ar dauguma joninių junginių ištirps, kai jie bus dedami į vandenį. Iš tiesų, kai kurios molekulės ištirpsta, net jei nepastebi pokyčių. Todėl eksperimentui, reikalaujančiam didesnio tikslumo, gali tekti naudoti skaičiavimo metodą.
etapai
1 dalis Laikykitės greitų taisyklių
- Sužinokite daugiau apie joninius junginius. Kiekviename atome yra tam tikras elektronų kiekis. Tačiau yra atvejų, kai atomas pritraukia arba praranda vieną ar daugiau elektronų. Taigi jis tampa a jonųtai yra, elektra įkraunama cheminė rūšis. Kai neigiamai įkrautas jonas (turintis vieną ar daugiau papildomų elektronų) asocijuojasi su teigiamai įkrautu jonu (kuris prarado vieną ar daugiau elektronų), susidaro jungtis tokiu pačiu būdu, kaip tenkinami priešingi magnetų įkrovos poliai. Taip susidaro joninis junginys.
- Jonai, turintys neigiamus krūvius, vadinami anijonas ir tie, kuriems teigiamas krūvis yra katijonas.
- Paprastieji atomai turi tą patį protonų ir elektronų skaičių, todėl įmanoma neutralizuoti elektros krūvius.
-
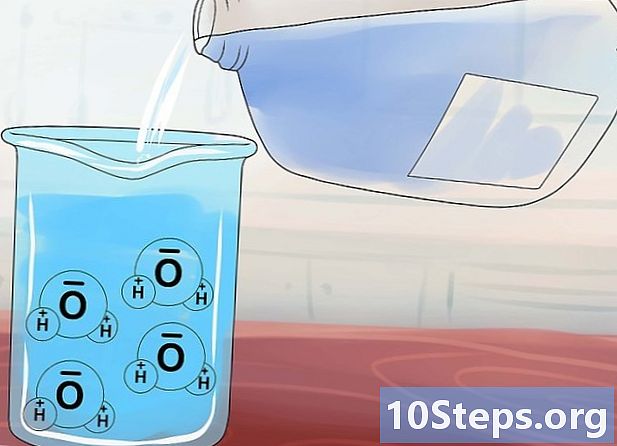
Suprasti tirpumo sąvoką. Vandens molekulės (H2O) turi neįprastą struktūrą, dėl kurios jie panašūs į magnetą tuo, kad turi teigiamą ir neigiamą pabaigą. Įpilant joninį junginį į vandenį, šie „skystieji magnetai“ traukiasi aplink junginį ir bando atskirti anijonus nuo katijonų.- Joninių junginių, kurių cheminė jungtis nėra pakankamai stipri, yra tirpusnes vandens molekulės gali lengvai jas atskirti ir ištirpinti. Priešingai, junginiai su stipresniais ryšiais yra atsparesni ir yra netirpusnes vandens molekulės nesugeba jų atskirti.
- Kai kurių iš šių junginių vidinės jungtys turi panašų stiprumą, kokį jas veikia vanduo. Šie junginiai laikomi mažai tirpstanes nemaža dalis ištirpsta vandenyje, o likusi dalis lieka vieninga.
-

Sužinokite tirpumo taisykles. Kadangi atomų sąveika yra gana sudėtinga, junginio tirpumą ne visada lengva nustatyti. Stebėkite pirmąjį savo junginio joną, kad pamatytumėte, kaip jis paprastai reaguoja, tada patikrinkite išimtis, kad įsitikintumėte, ar jis nereaguoja tam tikru būdu.- Pavyzdžiui, norėdami sužinoti, ar stroncio chloridas (SrCl2) tirpsta ar ne, stebėkite liūto Sr arba Cl. Cl elgesį paprastai tirpsta, tada patikrinkite, ar chloras yra taisyklės išimtis. Sr nėra išimtis, o tai reiškia, kad SrCl2 yra tirpus junginys.
- Toliau aprašytos pagrindinės kiekvienos taisyklės išimtys. Yra ir kitų išimčių, tačiau su jomis sutiksite tik per chemijos užsiėmimus ar patirtį laboratorijoje.
-

Atminkite, kad junginys tirpsta, jei jame yra šarminio metalo. Tai apima: Li, Na, K, Rb ir Cs. Šie metalai yra įtraukti į 1 grupės (IA) elementų sąrašą. Tai apima ličio, natrio, kalio, rubidžio ir cezio. Beveik visi joniniai junginiai, turintys vieną iš šių elementų, yra tirpūs.- Išimtis: li3pašto4 yra netirpus.
-
Žinoti kitus tirpius junginius. Žinokite, kad nėra junginio3, C2O3O2, NE2, ClO3 arba ClO4 tirpsta. Tai atitinkamai yra nitrato, acetato, nitrito, chlorato ir perchlorato jonai. Atminkite, kad lacetatas dažnai sutrumpinamas kaip OAC.- Išimtys: Ag (OAc) (sidabro acetatas) ir Hg (OAc)2 (gyvsidabrio acetatas) netirpsta.
- AgNO2 ir KClO4 yra mažai tirpūs.
-

Atminkite, kad Cl, Br ir I junginiai dažnai tirpsta. Chlorido, bromido ir jodido jonai beveik visada sudaro tirpius junginius, vadinamus halogenintomis druskomis.- Išimtis: vieno iš šių jonų derinys su jonais Ag (sidabro), Hg2 (gyvsidabris) arba Pb (švinas) sukuria netirpių junginių. Tai taip pat taikoma rečiau junginiams, gaunamiems iš Cu (vario) ir Tl (talio) jonų.
-

Atminkite, kad junginiai, kurių sudėtyje yra SO4 paprastai tirpsta. Liūto sulfatas paprastai sudaro tirpius junginius, tačiau yra keletas išimčių.- Išimtys: liūto sulfatas sukuria netirpius junginius su šiais jonais: Sr (stroncis), Ba (baris), Pb (švinas), Ag (sidabras), Ca (kalcis), Ra (radis) ir Ag2 (diatominis sidabras). Atminkite, kad sidabro sulfatas ir kalcio sulfatas ištirpsta tiek, kad būtų laikomi mažai tirpiais junginiais.
-

Atminkite, kad junginiai, kurių sudėtyje yra OH arba S, yra netirpūs. Jie yra atitinkamai hidroksidas ir sulfidas.- Išimtys: ar atsimenate šarminius metalus (IA grupės elementus) ir kaip jie sudaro tirpius junginius? Li, Na, K, Rb ir Cs yra visi jonai, kurie sudaro tirpius junginius su hidroksidu ir sulfidu. Be to, hidroksidas sudaro tirpias druskas su šarminiais žemės metalais (antrosios grupės cheminiais elementais): Ca (kalcis), Sr (stroncis) ir Ba (baris). Junginiai, susidarantys dėl jungties tarp hidroksilo ir šarminių žemės metalų, turi pakankamai molekulių, kurios išlieka kompaktiškos ir kartais laikomos mažai tirpiais junginiais.
-

Atminkite, kad junginiai, kurių sudėtyje yra CO3 arba PO4 yra netirpūs. Tai atitinkamai karbonatas ir fosfato liūtas ir jūs turėtumėte žinoti, ko tikėtis naudojant šiuos junginius.- Išimtys: šie jonai sudaro tirpius junginius su šarminiais metalais (Li, Na, K, Rb ir Cs), taip pat amonio liūtu NH4.
2 dalis Apskaičiuokite K tirpumąSp
-

Ieškokite tirpumo produkto konstantos KSp. Tai yra skirtinga kiekvieno junginio konstanta, vadinasi, jo turite ieškoti lentelėje arba internete. Kadangi tirpumo produktas Ksp nustatomas eksperimentiniu būdu, jis gali labai skirtis priklausomai nuo jūsų naudojamos diagramos, todėl geriausia kreiptis į savo chemijos knygą. Jei nenurodyta kitaip, dauguma lentelių rodo Ksp reikšmes kelioms kietosioms medžiagoms esant 25 ° C.- Pavyzdžiui, jei ištirpsite švino liodidą (PbI2), pažymėkite jo tirpumo konstantą. Jei naudojate šią lentelę, turite naudoti 7,1 × 10.
-

Parašykite cheminę lygtį. Pirmiausia nustatykite, kaip jūsų cheminė rūšis suskyla į jonus, kai ji ištirpsta, tada parašykite lygtį, gaudami konstantą K vienoje pusėje.Sp ir sudedamieji jonai kitoje pusėje.- Pavyzdžiui, PbI molekulės2 Jie suskaidomi į Pb, I ir I jonus, kadangi junginio elektroninis krūvis yra neutralus, norint apskaičiuoti kito jonų krūvį, pakanka žinoti vieno iš jonų krūvį.
- Parašykite lygtį taip: 7,1 × 10 =.
- Lygtis susijusi su cheminio kūno tirpumo konstanta. Jį galite rasti tirpumo produktų lentelėje. Kadangi yra 2 I jonai, šį elementą turite padidinti kvadratu.
-

Iš naujo suformuluokite lygtį, kad naudotumėte kintamuosius. Parašykite lygtį taip, lyg tai būtų paprasta algebrinė problema, naudojant dalyvaujančių molekulių ir dionų skaičių. Norėdami tai padaryti, tarkime, kad x yra lygus junginio kiekiui, kuris ištirps ir pertvarkys kintamuosius, vaizduojančius kiekvieno jono kiekius taip, kad jie priklausytų nuo x.- Mūsų pavyzdyje turime jį perrašyti kaip 7,1 × 10 =.
- Kadangi junginyje yra švino jonų (Pb), ištirpusių molekulių skaičius turi būti lygus laisvųjų švino jonų skaičiui. Todėl = x.
- Kadangi kiekvienam švino jonui yra du diodų jonai (I), galime pasakyti, kad diodo duomenų rodiklis yra lygus 2x.
- Lygtis tampa tokia: 7,1 × 10 = (x) (2x).
-

Apsvarstykite paprastus atomus, jei tokių yra. Nepaisykite šio veiksmo, jei bandote ištirpinti junginį gryname vandenyje. Tačiau jei junginys ištirpinamas tirpale, kuriame yra vienas ar keli komponentai jonai („bendrieji jonai“), tirpios medžiagos tirpumas žymiai sumažėja. Šis poveikis yra ypač svarbus junginiuose, kurie beveik netirpsta. Tokiu atveju galite manyti, kad didžioji pusiausvyros jonų dalis susidaro iš tirpale esančių jonų. Parašykite lygtį, kad įtrauktumėte nežinomą tirpale esančių jonų molinę koncentraciją (mol / l arba M). Norėdami tai padaryti, pakeiskite x reikšmę, naudojamą šiam jonui.- Pavyzdžiui, jei švino jodido junginys buvo ištirpintas tirpale su 0,2 M švino chloridu (PbCl2), lygtis atrodytų taip: 7,1 × 10 = (0,2 M + x) (2x). Tuomet, kai 0,2 M koncentracija yra žymiai didesnė už x vertę, lygtį galima toliau perrašyti taip: 7,1 × 10 = (0,2 M) (2x).
-

Pabandykite išspręsti lygtį. Raskite x reikšmę, kad apskaičiuotumėte junginio tirpumą. Gautas atsakymas bus išreikštas ištirpusių junginių moliais litre vandens. Taip yra dėl to, kaip apibrėžta tirpumo konstanta. Todėl gali reikėti skaičiuoklės, kad galėtumėte rasti galutinį rezultatą.- Ši lygtis taikoma junginio tirpumui gryname vandenyje, o ne tirpale, kuriame yra bendrieji jonai.
- 7,1 × 10 = (x) (2x).
- 7,1 × 10 = (x) (4x).
- 7,1 × 10 = 4x.
- (7,1 × 10) ÷ 4 = x.
- x = ∛ ((7,1 × 10) ÷ 4).
- x = 1,2 x 10 mol / l, Tai ištirps apgamų kiekis. Kadangi tai yra labai mažas kiekis, galima sakyti, kad junginys netirpus.

- Lentelė, sugrupuojanti (KSp) įvairioms kietosioms medžiagoms
- Jei turite eksperimentinių duomenų apie ištirpusio junginio kiekį, galite naudoti tą pačią lygtį, norėdami rasti tirpumo konstantą KSp .
- Nėra visuotinai priimto šių terminų apibrėžimo, tačiau chemikai aukoja daugumą junginių. Kai kuriuos junginius, turinčius nemažą kiekį ištirpusių ir neištirpusių molekulių, tirpumo lentelėse galima apibūdinti skirtingai.
- Kai kuriose senovės knygose nagrinėjamas amoniakas (NH4OH) kaip tirpus junginys, kuris yra klaida. Nedideli NH dionų kiekiai4 ir OH gali būti aptinkami, tačiau jų negalima išskirti, kad susidarytų junginys.


