Turinys
Procentinė masė nustato kiekvieno elemento, sudarančio cheminį junginį, procentinę dalį. Norėdami rasti šią vertę, jums reikės junginių elementų molinės masės gramais / moliais arba gramų skaičiaus, sunaudoto tirpalui sukurti. Procentinė masė gali būti apskaičiuojama paprastai, naudojant pagrindinę formulę, kuri elemento (arba ištirpusios medžiagos) masę padalija iš junginio (arba tirpalo) masės.
Žingsniai
1 metodas iš 2: rasti procentinę masę su nurodytomis masėmis
- Apibrėžkite junginio masės procentinę lygtį. Pagrindinė junginio formulė yra tokia: masės procentinė dalis (() x 100). Norėdami išreikšti reikšmes procentais, pabaigoje turite padauginti iš 100.
- Cheminio junginio, kuris jus domina, masė yra problema, nurodyta masėje. Jei ši vertė nepateikiama, remkitės šiuo metodu ir sužinokite, kaip rasti masės procentą, kai masė nepateikiama.
- Bendra junginio masė apskaičiuojama pridedant visų elementų, naudojamų junginiui ar tirpalui sukurti, masę.
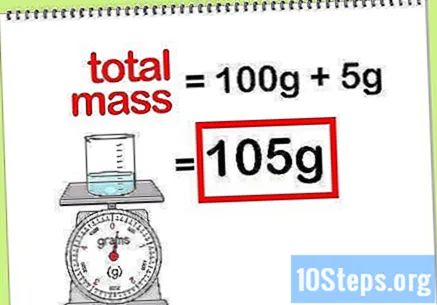
Apskaičiuokite bendrą junginio masę. Kai žinote visų pridedamų elementų ar junginių masės vertę, paprasčiausiai turite juos pridėti, kad apskaičiuotumėte junginio ar galutinio tirpalo masę. Ši vertė bus vardiklis apskaičiuojant procentinę masę.- Pavyzdžiui: Kokia yra 5 g natrio hidroksido, ištirpinto 100 g vandens, masė procentais?
- Bendra junginio masė yra natrio peroksido ir vandens kiekis: 100 g + 5 g, iš viso 105 g masės.

Nustatykite atitinkamos cheminės medžiagos masę. Kai jums reikia rasti procentinė masė, problema reikalauja, kad rastumėte konkretaus elemento (nagrinėjamo elemento) masę procentine visos elementų masės dalimi. Atkreipkite dėmesį į aptariamo elemento masę. Ši vertė bus skaitiklis apskaičiuojant procentinę masę.- Pavyzdžiui, elemento masė yra 5 g natrio hidroksido.
- Procentinės masės formulėje pakeiskite kintamuosius. Nustačius kiekvieno kintamojo reikšmes, pakeiskite jas lygtimi.
- Pavyzdžiui: masės procentinė dalis = () x 100 = () x 100.

Apskaičiuokite procentinę masę. Dabar, kai formuojasi lygtis, tiesiog išspręskite ją, kad apskaičiuotumėte procentinę masę. Padalinkite elemento masę iš bendros junginio masės ir padauginkite iš 100. Rezultatas bus procentinė cheminio elemento masė.- Pavyzdžiui: () x 100 = 0,04761 x 100 = 4,751%. Taigi 5 g natrio hidroksido, ištirpinto 100 g vandens, masės procentinė dalis yra 4,751%.
2 metodas iš 2: procentinės masės nustatymas nenurodytomis masėmis
- Apibrėžkite junginio masės procentinę lygtį. Pagrindinė junginio masės procentinė formulė yra tokia: masės procentinė dalis (() x 100. Pabaigę rezultatą padauginkite iš 100, kad reikšmės būtų išreikštos procentais.
- Kai nežinote masės verčių, galite rasti junginio elemento masės procentinę dalį naudodami molinę masę.
- Pavyzdžiui: Kokia yra vandenilio masės procentinė dalis vandens molekulėje?.
Parašyti cheminė formulė. Jei kiekvieno junginio cheminės formulės nepateikiamos, turėsite jas užrašyti. Kitu atveju pereikite prie veiksmo „Raskite kiekvieno elemento masę“.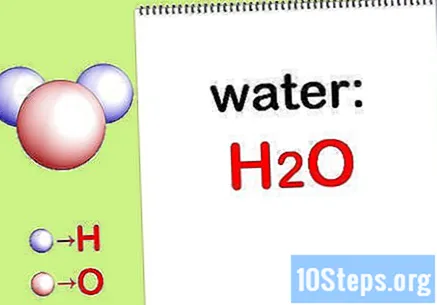
- Pavyzdžiui, užrašykite vandens cheminę formulę: H2.
Raskite kiekvieno junginio elemento masę. Ieškokite kiekvieno cheminių formulių elemento molekulinės masės, remdamiesi periodine lentele. Paprastai elemento masę galima rasti po cheminio elemento simboliu. Atkreipkite dėmesį į kiekvieno junginio elemento masę.
- Pavyzdžiui, deguonies molekulinė masė yra 15,9994, o vandenilio - 1,0079.
Padauginkite mases iš molinio santykio. Nustatykite, kiek kiekvieno elemento molių yra cheminiame junginyje. Apgamų skaičius nurodomas pagal pasirašytą junginio skaičių. Padauginkite kiekvieno elemento molekulinę masę iš molinio santykio.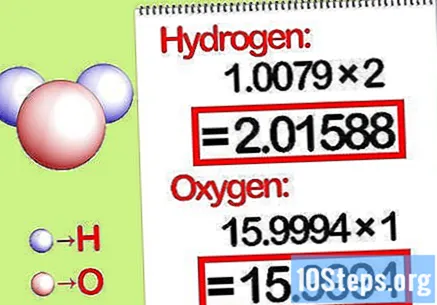
- Pavyzdžiui, vandenilio ir deguonies molinis santykis vandenyje yra 2: 1. Todėl padauginkite vandenilio molekulinę masę iš dviejų (1,00794 X 2 = 2,01588) ir palikite deguonies molekulinę masę tokią, kokia ji yra (15,9994).
Apskaičiuokite bendrą junginio masę. Pridedama bendra visų junginio elementų masė. Naudojant mases, apskaičiuotas pagal molinį santykį, galima apskaičiuoti bendrą junginio masę. Šis skaičius bus procentinės masės lygties vardiklis.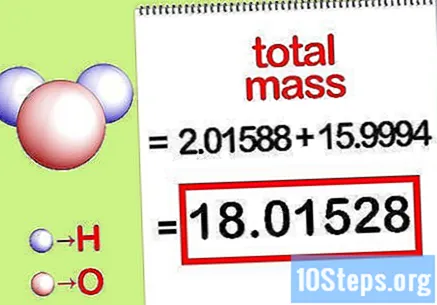
- Pavyzdžiui, pridėkite 2,01588 g / mol (dviejų molių vandenilio atomų masę) su 15,9994 g / mol (vieno deguonies atomo molio masė) ir gausite 18,01528 g / mol.
Nustatykite aptariamo elemento masę. Kai jums reikia rasti procentinė masė, problema reikalauja, kad rastumėte konkretaus junginio elemento masę procentais nuo visos elementų masės. Nustatykite aptariamo elemento masę ir užrašykite. Tai yra masės vertė, apskaičiuota naudojant molinį santykį. Ši vertė yra procentinės masės lygties skaitiklis.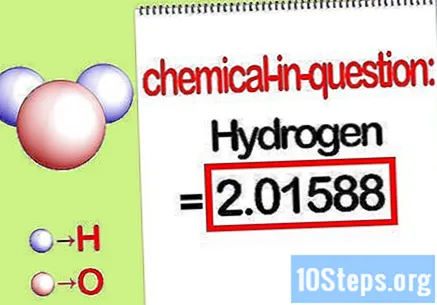
- Pavyzdžiui, junginio vandenilio masė yra 2,01588 g / mol (dviejų molių vandenilio atomų masė).
- Procentinės masės formulėje pakeiskite kintamuosius. Nustačius kiekvieno kintamojo reikšmes, pakeiskite jas pirmame žingsnyje apibrėžtoje lygtyje: masės procentinė dalis (() x 100).
- Pavyzdžiui: masės procentinė dalis = () x 100 = () x 100.
Apskaičiuokite procentinę masę. Dabar, kai formuojasi lygtis, tiesiog išspręskite ją, kad apskaičiuotumėte procentinę masę. Padalinkite elemento masę iš bendros junginio masės ir padauginkite iš 100. Rezultatas bus procentinė cheminio elemento masė.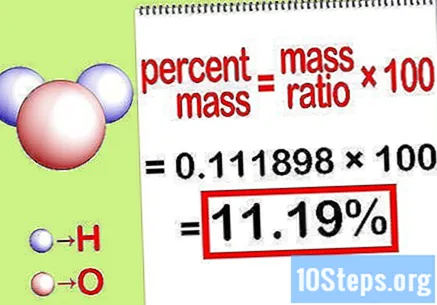
- Pvz., Masės procentinė dalis = () x 100 = 0,1111189 x 100 = 11,18%. Taigi vandenilio atomų masės procentinė dalis vandens molekulėje yra 11,18%.